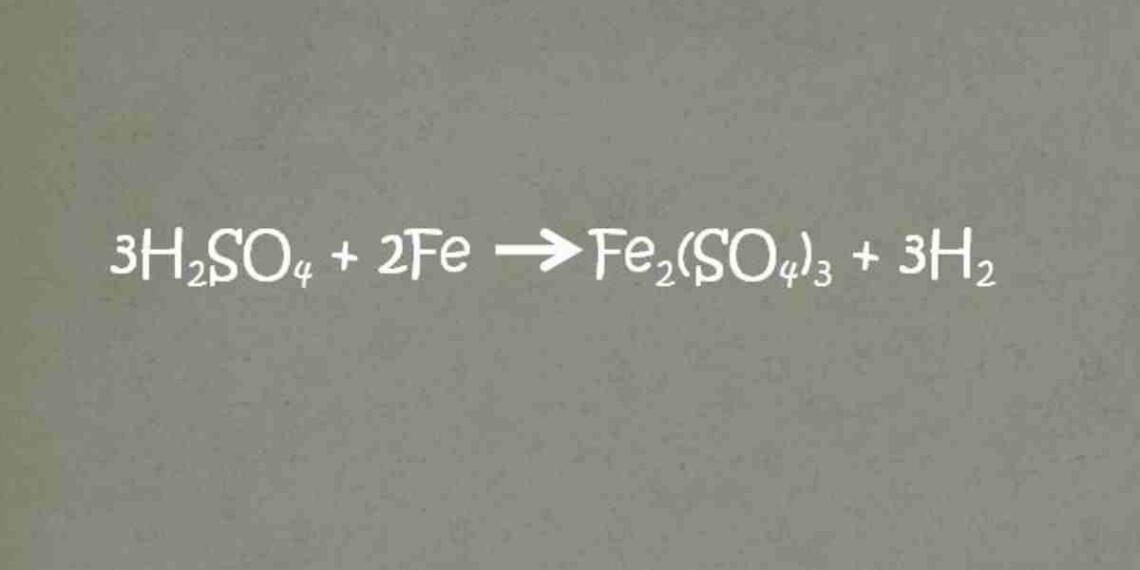रासायनिक समीकरण किसे कहते है?
किसी भी रासायनिक अभिक्रिया को रासायनिक समीकरण के द्वारा दर्शाया जाता हैं. अर्थात जो अभिकारक तथा उत्पाद के सूत्र को प्रदर्शित करता है, उसे रासायनिक समीकरण कहा जाता है.
समीकरण में आवश्यक परिस्थितियाँ जैसे-ताप, दाब, उत्प्रेरक आदि को तीर के निशान के ऊपर या नीचे दर्शाया जाता हैं.
रासायनिक समीकरण को लिखने का तरीका –
अभिकारक – वह पदार्थ जो किसी रासायनिक अभिक्रिया में भाग लेते हैं, उन्हें अभिकारक कहते हैं. यह तीर के निशान के बायीं और लिखे जाते हैं.
उत्पाद – जिन पदार्थों का निर्माण रासायनिक अभिक्रिया में होता हैं, उन्हें उत्पाद कहा जाता हैं. यह तीर के निशान के दायीं और लिखे जाते हैं.
उत्प्रेरक – वह पदार्थ जो रासायनिक अभिक्रिया में भाग नहीं लेता हैं पर अभिक्रिया के वेग की दर को परिवर्तित कर देता हैं, उसे उत्प्रेरक कहते हैं. यह तीर के निशान के ऊपर लिखे जाते हैं.
रासायनिक समीकरण का सूत्र – क्रियाकारक/ अभिकारक ——-> उत्पाद / क्रियाफल
जैसे- A + B (अभिकारक) = C + D (उत्पाद)
H2 + O = H2O
रासायनिक समीकरण के प्रकार :-
समीकरण सामान्यता दो प्रकार के होते है.
(1) संतुलित रासायनिक समीकरण
(2) असंतुलित रासायनिक समीकरण / कंकाली समीकरण
(1) संतुलित रासायनिक समीकरण :-
रासायनिक अभिक्रिया में अभिकारक और उत्पाद के परमाणुओं की संख्या तथा परमाणु भार एक समान होता है.उसे संतुलित समीकरण कहते हैं.
उदाहरण :-
(1) C + O2 → CO2
परमाणु भार – 12 + 2 x 16 , 12 + 2 x 16
12 + 32, 12 + 32
44 44
(2)असंतुलित समीकरण या कंकाली समीकरण :-
रासायनिक अभिक्रिया में अभिकारक और उत्पाद के परमाणुओं की संख्या तथा उनका परमाणु भार एक समान नहीं होता हैं. उसे असंतुलित समीकरण या कंकाली समीकरण कहा जाता हैं.
जैसे – 2Mg + O2 → MgO (अभिकारक) (उत्पाद)
विधियाँ
इसके अंतर्गत मुख्य रूप से दो विधियाँ हैं-
1. आंशिक विधि
2. अनुमान विधि
आंशिक विधि- इस विधि अंतर्गत जटिल समीकरणों को संतुलित किया जाता है, इसमें जटिल समीकरण को आंशिक समीकरण के रूप में लिखा जाता हैं.वहीं आंशिक समीकरणों को संतुलित कर लेते हैं. यदि आंशिक समीकरण संतुलित नहीं है तो इसे किसी पूर्णांक संख्या से गुणा कर देते हैं. इसके बाद इन आंशिक समीकरणों को इस प्रकार जोड़ते हैं कि माध्यमिक उत्पाद जो अंतिम क्रिया में प्राप्त नहीं होते हैं, कट जाएँ या विलुप्त हो जाएँ.
उदाहरण- कास्टिक सोडा पर ठंडे क्लोरीन जल की क्रिया से NaCl व सोडियम हाइपोक्लोराइड (NaOCl) एवं जल बनता है.
Cl2 + H2O = HCl + HOCl
NaOH + HCl = NaCl + H2O
NaOH + HOCl = NaOCl + H2O
अभीष्ट समीकरण-
Cl2 + 2 NaOH = NaCl + NaOCl + H2O
और पढ़े: ग्लूकोज का सूत्र और इसका उपयोग क्या है।
अनुमान विधि- इस विधि द्वारा केवल सरल समीकरणों को ही संतुलित किया जाता है. इस विधि में सबसे पहले रासायनिक समीकरण का ढाँचा लिखा जाता हैं, फिर अभिक्रिया में गैसीय पदार्थों को परमाणवीय अवस्था में लिखते हैं. अभिकारक एवं उत्पाद को उचित संख्या से गुणा करके दोनों ओर के परमाणुओं की संख्या को बराबर कर लेते हैं तथा परमाणवीय अवस्था में गैसों को आण्विक अवस्था में बदलने के लिए दोनों ओर 2 से गुणा कर देते हैं.
उदाहरण- पोटेशियम क्लोरेट को गर्म करने पर पोटेशियम क्लोराइड व ऑक्सीजन बनते हैं.
KClO3 =(गर्म) KCl + O (ढाँचा समीकरण)
KClO3 = KCl + 3 O (परमाण्विक समीकरण)
2 KClO3 = 2 KCl + 3 O2 (आण्विक समीकरण)
कॉपर को सांद्र सल्फ्यूरिक अम्ल के साथ गर्म करने पर कॉपर सल्फेट, सल्फर डाई ऑक्साइड (SO2) व जल (H2O) बनता है.
Cu + H2SO4 =(गर्म) CuSO4 + SO2 + H2O (ढाँचा समीकरण)
Cu + 2 H2SO4 = CuSO4 + SO2 + H2O (परमाण्विक समीकरण)
Cu + 2 H2SO4 = CuSO4 + SO2 + 2 H2O (आण्विक समीकरण)
आशा करते है कि यह लेख आपको पसंद आया होगा ऐसे ही लेख और न्यूज पढ़ने के लिए कृपया हमारा ट्विटर फॉलो करें.