इलेक्ट्रॉन बंधुता क्या है? प्रमुख बिंदु – Electron affinity in Hindi
किसी परमाणु या अणु की इलेक्ट्रॉन बंधुता (electron bandhuta) उस कण की इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति है। यह सभी गैर-महान गैस तत्वों के लिए एक एक्ज़ोथिर्मिक प्रक्रिया (Exothermic process) है। तत्वों की आवर्त सारणी के पार और नीचे इलेक्ट्रॉन बंधुता में सामान्य रुझान हैं। आवर्त सारणी में आम तौर पर एक आवर्त में इलेक्ट्रॉन बंधुता बढ़ती है और कभी-कभी एक समूह में घट जाती है। जरूरी नहीं कि ये रुझान सार्वभौमिक हों। आवर्त सारणी में इलेक्ट्रॉन बंधुता में परिवर्तन के लिए रासायनिक तर्क एक अवधि और एक समूह में प्रभावी परमाणु प्रभार में वृद्धि है।
इलेक्ट्रॉन बंधुता के मामले
इलेक्ट्रॉन बंधुता (electron bandhuta) एक परमाणु (nuclear) या अणु (atom) की इलेक्ट्रॉन बंधुता को ऊर्जा की मात्रा के रूप में परिभाषित किया जाता है जब एक इलेक्ट्रॉन को एक तटस्थ परमाणु या अणु में जोड़ा जाता है जिससे एक नकारात्मक आयन बनता है।
इलेक्ट्रोनगेटिविटी एक परमाणु या अणु की अपनी ओर इलेक्ट्रॉनों को आकर्षित करने की प्रवृत्ति।
एक तटस्थ परमाणु या अणु की इलेक्ट्रॉन बंधुता (ईईए) को ऊर्जा की मात्रा के रूप में परिभाषित किया जाता है जब एक इलेक्ट्रॉन को ऋणात्मक आयन बनाने के लिए इसमें जोड़ा जाता है, जैसा कि निम्नलिखित समीकरण द्वारा प्रदर्शित किया गया है:
प्रथम इलेक्ट्रॉन बंधुता (नकारात्मक ऊर्जा क्योंकि ऊर्जा मुक्त होती है):
X(g)+e^-→X^- (g)
दूसरा इलेक्ट्रॉन बंधुता (सकारात्मक ऊर्जा क्योंकि ऊर्जा की आवश्यकता प्राप्त से अधिक है):
X^- (g)+e^-→X^(2-) (g)
इलेक्ट्रॉन बंधुता केवल गैसीय अवस्था में परमाणुओं और अणुओं के लिए मापी जाती है, क्योंकि ठोस या तरल अवस्था में अन्य परमाणुओं या अणुओं के संपर्क से उनकी ऊर्जा का स्तर बदल जाएगा। रॉबर्ट एस। मुलिकेन ने इलेक्ट्रॉन बंधुता और आयनीकरण क्षमता के औसत का पता लगाकर परमाणुओं के लिए एक इलेक्ट्रोनगेटिविटी स्केल विकसित करने के लिए इलेक्ट्रॉन समानता की एक सूची का उपयोग किया। एक अणु या परमाणु जिसमें अधिक सकारात्मक इलेक्ट्रॉन आत्मीयता मूल्य होता है, उसे अक्सर इलेक्ट्रॉन स्वीकर्ता कहा जाता है; कम सकारात्मक इलेक्ट्रॉन आत्मीयता (electron affinity) वाले व्यक्ति को इलेक्ट्रॉन दाता (electron donor) कहा जाता है। साथ में वे चार्ज-ट्रांसफर प्रतिक्रियाओं से गुजर सकते हैं।
और पढ़े: रासायनिक समीकरण किसे कहते है? प्रकार और विधियाँ?
इलेक्ट्रॉन समानता का ठीक से उपयोग करने के लिए, संकेत का ट्रैक रखना आवश्यक है। किसी भी प्रतिक्रिया के लिए जो ऊर्जा जारी करती है, ऊर्जा में परिवर्तन (ΔE) का नकारात्मक मूल्य होता है, और प्रतिक्रिया को एक्ज़ोथिर्मिक प्रक्रिया कहा जाता है। लगभग सभी गैर-महान गैस परमाणुओं के लिए इलेक्ट्रॉन कैप्चर में ऊर्जा की रिहाई शामिल है और इसलिए यह एक एक्ज़ोथिर्मिक प्रक्रिया है।
आवधिक गुण: भाग 4, आयनिक शुल्क, आयनीकरण ऊर्जा, इलेक्ट्रॉन आत्मीयता – हम संक्रमण धातुओं, आयनीकरण ऊर्जा और इलेक्ट्रॉन आत्मीयता (electron affinity) के आयनिक आवेशों की भविष्यवाणी को लपेटकर आवधिक गुणों की अपनी चर्चा समाप्त करते हैं।
EEA को E समझने से भ्रम की स्थिति उत्पन्न हो सकती है। EEA की तालिकाओं में सूचीबद्ध सभी संख्याएँ सकारात्मक हैं क्योंकि वे परिमाण हैं; इलेक्ट्रॉन समानता की एक तालिका में ईईए के मान सभी ऊर्जा की मात्रा को इंगित करते हैं जब एक इलेक्ट्रॉन को एक तत्व में जोड़ा जाता है। चूँकि ऊर्जा का विमोचन हमेशा एक ऊष्माक्षेपी घटना होती है, ये सभी E (एक ऊष्माक्षेपी प्रक्रिया को इंगित करते हुए) के नकारात्मक मूल्यों के अनुरूप होते हैं।
और पढ़े : विज्ञान के खिलाफ़ वामपंथियों का युद्ध
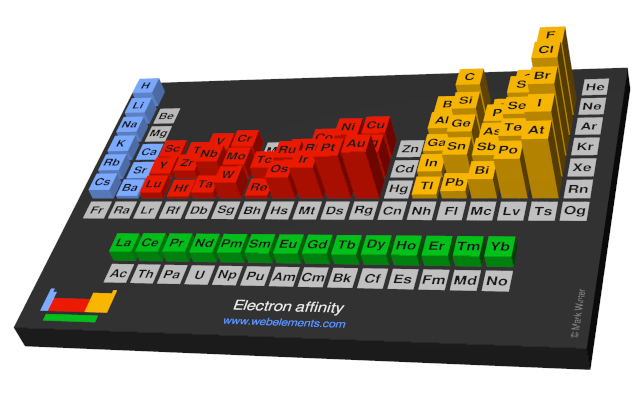
इलेक्ट्रॉन आत्मीयता में आवधिक रुझान
हालांकि ईईए आवर्त सारणी में बहुत भिन्न होता है, कुछ पैटर्न उभर कर आते हैं। आम तौर पर, अधातुओं में धातुओं की तुलना में अधिक धनात्मक EEA होता है। परमाणु, जैसे कि समूह 7 के तत्व, जिनके ऋणायन तटस्थ परमाणुओं की तुलना में अधिक स्थिर होते हैं, उनमें EEA अधिक होता है। उत्कृष्ट गैसों की इलेक्ट्रॉन समानता को निर्णायक रूप से नहीं मापा गया है, इसलिए उनके पास थोड़ा नकारात्मक मूल्य हो सकता है या नहीं भी हो सकता है। क्लोरीन में सबसे अधिक EEA होता है जबकि पारा में सबसे कम होता है।
ईईए आम तौर पर आवर्त सारणी में एक अवधि (पंक्ति) में बढ़ता है, परमाणु के वैलेंस शेल के भरने के कारण। उदाहरण के लिए, इसी अवधि के भीतर, एक समूह -17 परमाणु एक इलेक्ट्रॉन प्राप्त करने पर समूह -1 परमाणु की तुलना में अधिक ऊर्जा जारी करता है क्योंकि जोड़ा गया इलेक्ट्रॉन एक भरा वैलेंस शेल बनाता है और इसलिए अधिक स्थिर होता है।
आवर्त सारणी में समूहों के नीचे EEA घटने की प्रवृत्ति अपेक्षित होगी, क्योंकि अतिरिक्त इलेक्ट्रॉन नाभिक से दूर एक कक्षीय कक्ष में प्रवेश कर रहा है। चूंकि यह इलेक्ट्रॉन अधिक दूर है, इसलिए इसे नाभिक की ओर कम आकर्षित होना चाहिए और जोड़ने पर कम ऊर्जा छोड़नी चाहिए। हालाँकि, यह प्रवृत्ति केवल समूह -1 परमाणुओं पर लागू होती है। इलेक्ट्रॉन बंधुता वैद्युतीयऋणात्मकता की प्रवृत्ति का अनुसरण करती है: फ्लोरीन (F) में ऑक्सीजन (O) की तुलना में अधिक इलेक्ट्रॉन बंधुता होती है, और इसी तरह।
यहां बताए गए रुझान आयनीकरण ऊर्जा और समान (हालांकि विरोधी) कारणों से परिवर्तन के समान हैं।
और पढ़े : विज्ञान भी मानता है कि, न राम काल्पनिक हैं और ना ही राम सेतु